NA表示阿伏加德罗常数的值,则下列说法正确的是
| A.1摩尔任何物质都含NA个原子 |
| B.0.1 mol/L K2SO4溶液中含有 K+为0.2 NA |
| C.常温常压下,铁与盐酸发生置换反应,生成22.4L氢气,则参加反应的铁原子的个数为NA |
| D.标准状况下,22.4L以任意比混合的CO、CO2混合气体所含碳原子数约为NA |
在100 mLCuSO4的溶液中,用石墨作电极电解一段时间,两极均收到2.24L气体(标准状况),则原溶液中,Cu2+的物质的量浓度为 ()
| A.1mol•L―1 | B.2mol•L―1 | C.3 mol•L―1 | D.4 mol•L―1 |
在一定温度下,容器内某一反应中M、N的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )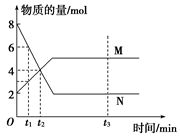
A.反应的化学方程式为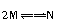 |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
下图装置堪称多功能电化学实验装置。下列有关此装置的叙述中,不正确的是()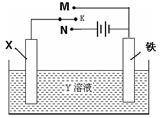
| A.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| B.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
| C.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| D.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
两种气态烃的混合气体共1mol,在空气中燃烧得到1.5molCO2和2molH2O。关于该混合气体的说法正确的是( )
| A.一定含甲烷,但不含乙烯 | B.一定含乙烷,不含甲烷 |
| C.一定是甲烷和乙烯的混合气体 | D.一定含有甲烷,不含乙烷 |
短周期元素X、Y、Z在元素周期表中的位置如下图所示,下列说法正确的是( )
| A.X、Y、Z三种元素中,X的非金属性最强 |
| B.X的单质的熔点比Z的低 |
| C.Y的最高正化合价为+7 |
| D.Y的氢化物的稳定性比Z的弱 |