I.下列分子中,立体构型是平面三角形的是_____。
| A.CH4 | B.NH3 | C.BF3 | D.SO3 |
II.氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有______种;氟原子的外围电子排布式为________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有____;与HF2-互为等电子体的分子有______(举一例)。
(3)C2F4分子中,碳原子的杂化轨道类型为________。
(4)三氟化硼乙醚(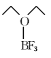 )的熔点为-58℃,沸点为126~129℃,它属于_____晶体。
)的熔点为-58℃,沸点为126~129℃,它属于_____晶体。
金属铜的晶胞是一个“面心立方体”(注:八个顶点和六个面分别有一个金属原子)。则金属铜平均每个晶胞中有__________个金属原子组成的。已知铜的摩尔质量是64g·mol—1,金属铜的密度是8.93g·cm-3。则金属铜的晶胞体积是。计算过程为:
将H2S、HF、HCl、HI、CH4、NH3、H2O、MgO、SiO2、CO2、SO2、NaCl、NaOH等化合物按以下要求填空:
(1)具有强极性键的弱酸是,具有强极性键的强酸是,具有弱极性键的强酸是,具有弱极性键的弱酸是,其水溶液有强碱性的是,其水溶液有弱碱性的是。
(2)属于离子化合物的是。
(3)属于分子晶体的氧化物是,属于原子晶体的氧化物是。
(4)具有正四面体构型的化合物是,难溶于水的气态氢化物是,难溶于水的氧化物是。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为
(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
。
在下列H2O、H2O2、Ba(OH)2、Na2O2、K2O等化合物中,由离子键和极性键构成的化合物是;由离子键和非极性键构成的化合物是;由极性键和非极性键构成的化合物是。
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。
请回答下列问题:
(1)Na3N是由_________键形成的化合物。
(2)Na3N与盐酸反应生成__________种盐。
(3)Na3N与水的反应属于______________反应