设NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.0.1mol·L-1的NaCl溶液中Cl-的数目为0.1NA |
| B.16g O3中所含的氧原子数为NA |
| C.22.4L H2中含有的氢原子数一定为2NA |
| D.1molCl2与过量的金属钠充分反应后,转移的电子数为NA |
下列化学用语正确的是
A.硫的原子结构示意图: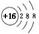 |
B.NH4Cl的电子式: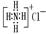 |
C.原子核内有8个中子的氧原子: |
| D.Be2+离子中的质子数和电子数之比为2:1 |
某反应的反应过程和能量变化如图所示,下列有关该反应的叙述正确的是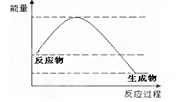
| A.该反应的反应热△H < 0 |
| B.反应物的总能量低于生成物的总能量 |
| C.该反应是吸热反应 |
| D.加入催化剂后反应放出的热会减少 |
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
| A.盐酸的浓度 | B.铝条的表面积 | C.溶液的温度 | D.加少量Na2SO4 |
已知热化学方程式C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是
| A.乙炔的燃烧热为1256kJ/mol |
| B.若转移10mol电子,则消耗2.5mol O2 |
| C.若生成2mol液态水,则△H=-2512kJ/mol |
| D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
能说明醋酸是弱电解质的是
①往苯酚钠溶液中加入醋酸可得苯酚
②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢
④pH=2的醋酸溶液稀释1000倍后pH小于5
| A.①③④ | B.①② | C.②④ | D.② |