Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)  。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min |
0 |
20 |
40 |
60 |
80 |
120 |
| x(HI) |
1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
| x(HI) |
0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.5×10-16 |
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
已知25℃、101kPa下,如右图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是: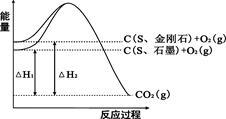
| A.金刚石比石墨稳定 |
| B.C(s、石墨)=C(s、金刚石) △H =+1.5kJ/mol |
| C.△H1<△H2 |
| D.如果使用催化剂,△H1和△H2都变小 |
某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)=Z(g)+W(s) ΔH > 0,一段时间后,达到化学平衡状态。下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.通入一定量氦气,压强增大,平衡向正反应方向移动 |
| C.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| D.降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
关于小苏打水溶液的表述正确的是
A.存在电离只有HCO3— H+ + CO32—,H2O H+ + CO32—,H2O  H+ + OH— H+ + OH— |
| B.HCO3—的电离程度大于HCO3—的水解程度 |
| C.c (Na+) + c (H+)=" c" (HCO3—)+ c (CO32—)+ c (OH—) |
| D.c (Na+) =" c" (HCO3—)+ c (CO32—)+ c (H2CO3) |
下列用来表示物质变化的反应式中,正确的是
| A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH- |
B.常温下,NaHCO3溶液显碱性:HCO3— + H2O  CO32—+ H3O+ CO32—+ H3O+ |
| C.氢氧化镁与稀硫酸反应: H++ OH— = H2O |
| D.硫酸亚铁酸性溶液中加入过氧化氢: Fe2+ + H2O2 + 2H+ = Fe3+ + 2H2O |