已知一个碳原子上连有两个羟基时,易发生下列转化: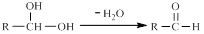 。请根据下图回答:
。请根据下图回答:
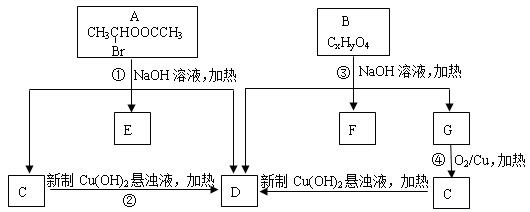
(1)A中所含官能团的名称为 。
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,其峰值比为2︰2︰2︰3︰3,其中苯环上的一氯代物只有两种。则B的结构简式为 。
(3)写出下列反应方程式:
① ; ④ 。
(4)符合下列条件的B的同分异构体共有 种。
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;
③能发生水解反应和银镜反应。
(5)已知: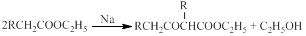
请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。合成路线流程图示例: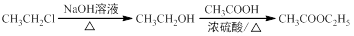
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 |
Mg2(OH)2CO3 |
CaCO3 |
BaSO4 |
BaCO3 |
| 2.6×10-2 |
2.5×10-4 |
7.8×10-4 |
2.4×10-4 |
1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
①过程Ⅳ除去的离子有______、_______。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是___________________________。
③过程VI中,产品NaOH在电解槽的______区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
选考[化学——选修5:有机化学基础](13分)
阿托酸乙酯可用于辅助胃肠道痉挛及溃疡。阿托酸乙酯的一种合成路线如下图所示: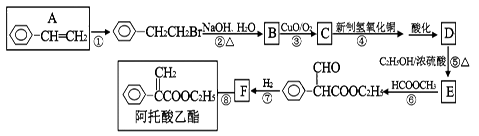
请回答下列问题:
(1)E的分子式为,F的结构简式,阿托酸乙酯所含官能团的名称;
(2)在反应①②③④⑤⑥⑦⑧中,属于取代反应的有;
(3)反应③的方程式。
(4)有关阿托酸乙酯的说法正确的是()
A.能使高锰酸钾褪色,不能使溴水褪色
B.1mol阿托酸乙酯最多能与4molH2加成
C.能发生加成、加聚、氧化、水解等反应
D.分子式为C11H13O2
(5)D的同分异构体有多种,符合含有苯环且能与碳酸氢钠反应放出气体的同分异构体有种(不包含D)。
选考[化学——选修3:物质结构与性质] (13分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的价电子排布式,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有(填元素符号),上述方程式中涉及到的N、O、P、S元素第一电离能由小到大的顺序为。及电负性由小到大的顺序为。
(2)氨基乙酸铜的分子结构如图,氮原子的杂化方式为。
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为。
(4)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为。
(14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:。装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:。
(5)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气0.06 mol。(填“大于”“小于”“等于”),若有17.4 g的MnO2被还原,则被氧化的HCl的质量为。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。