常温下,下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、HCO3- |
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O2与18O2互为同位素 |
| B.用石墨电极电解含有一定量H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
| C.20g H218O中含有12mol质子 |
D.SO3中的三个S-O键是等同的,向 2SO2(g) + O2(g)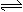 2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中 2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中 |
关于下列图示的说法中错误的是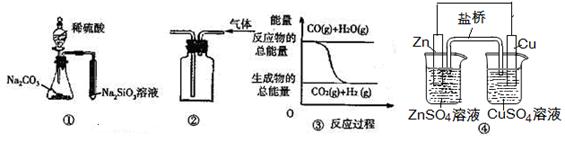
| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集H2气体 |
C.图③表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”为放热反应 CO2(g)+H2(g)”为放热反应 |
| D.图④中的装置可形成持续稳定的电流。将锌片浸入CuSO4溶液中发生的化学反应与图④中的原电池装置反应不相同 |
A、B、C、D、E 是同一短周期的五种元素, A和B的最高价氧化物对应的水化物呈碱性,且碱性前者强于后者,C和D的气态氢化物的水溶液呈酸性,且酸性前者强于后者,分别由C、D、E三种元素形成的单核离子中,E元素的离子半径最大,则它们的原子序数由大到小的顺序是
A.CDEBA B.ECDAB C.BAEDC D.BADCE
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,外电路电流由D到C;③A、C用导线相连后,同时浸入稀H 2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>C>D>B B.A>B>C>D
C.C>A>D>B D.C>B>D>A
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列说法正确的是
| A.如图所示条件下,实验过程中没有热量损失 |
| B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说两次实验放出热量相等 |
| C.图中实验装置缺少环形玻璃搅拌棒 |
| D.烧杯间填满碎纸条的作用是固定小烧杯 |