准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-l的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为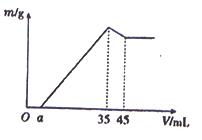
| A.3.50mol/L | B.1.75mol/L | C.0.85mol/L | D.无法计算 |
下列有关海水综合利用的说法正确的是()
| A.通过物理变化可以从海水中得到钾单质 |
| B.利用潮汐发电是将化学能转化为电能 |
| C.从海水中可得到NaCl,电解熔融NaCl可制备Na |
| D.海水蒸发制海盐的过程中只发生了化学变化 |
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;
③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是()
| A.②④⑤③① | B.③②④①⑤ | C.③④②⑤① | D.②④③⑤① |
某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,已知NO2和 O2的分子个数比为4∶1,则在分解过程中该金属的化合价将()
| A.不变 | B.降低 | C.升高 | D.无法确定 |
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是()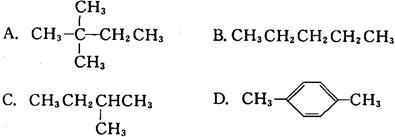
1mol乙烯和氯化氢发生加成反应生成氯乙烷,该氯乙烷继续和Cl2发生取代反应,最多可消耗Cl2的物质的量为()
| A.5mol | B.3mol | C.4mol | D.2.5mol |