已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且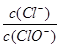 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后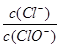 =11,则溶液中 =11,则溶液中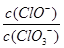 = =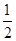 |
B.参加反应的氯气的物质的量等于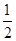 a mol a mol |
C.改变温度,产物中KClO3的最大理论产量为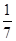 a mol a mol |
D.改变温度,反应中转移电子的物质的量ne的范围: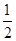 a mol≤ne≤ a mol≤ne≤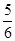 a mol a mol |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,22.4L NH3中含有3NA个N-H键 |
| B.1 mol·L-1 CaCl2溶液含有NA个Ca2+ |
| C.48g O3和O2的混合气体中含有3NA个O原子 |
| D.1 molNO2溶于水后溶液中含有NA个NO3- |
下列关于有机物的说法正确的是
| A.分子式为C6H6的物质一定是苯 |
| B.“西气东输”中的“气”主要成分是甲烷 |
| C.乙烯使溴水褪色说明乙烯与溴发生了取代反应 |
| D.蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
下图为元素周期表中短周期的一部分,下列说法正确的是
| ① |
② |
③ |
| ④ |
⑤ |
⑥ |
A.①~⑥可能全部是非金属元素
B.对应单质的活泼性:②>③
C.④的最高价氧化物对应的水化物可能为两性物质
D.②、⑤的最高价氧化物对应的水化物可能均为强酸
有关下列溶液的叙述正确的是
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
n(K+) = n(S2-)+n(HS-)+n(H2S) = 1mol
下列实验操作不正确的是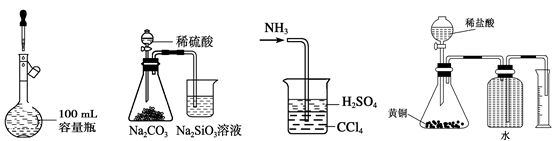
A. B. C. D. A.定容
A.定容
B.比较硫、碳、硅三种元素的非金属性强弱
C.处理尾气
D.测定黄铜(Cu、Zn合金) 中Zn的含量