CO和NO都是常见的不成盐氧化物。回答下列问题:
(1)工业土用一氧化碳制取氢气的反应为:CO(g) + H2O(g) CO2(g) + H2(g),
已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
恒温恒容条件下,以下能说明该反应达到平衡状态的是 (填字母序号)。
a.V消耗(CO) = V生成(H2O)
b. c(CO2)=c(CO)
c. 混合气体的总物质的量不再改变
d. 混合气体的密度不再改变
(2)①汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:

写出该反应的热化学方程式: _ 。
②通过NOx传感器可监测NOx的含量,其工作原理如图,写出NiO电极的电极反应式: 。
硫酸必须过量的目的是。
(本题共10分)
利用镁和稀硫酸反应,不仅可以测定1mol氢气的体积,装置如下左图,也可以测定镁带中镁的质量分数(杂质与酸反应不产生气体),装置如下右图。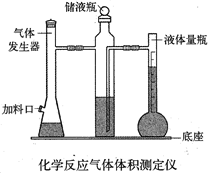
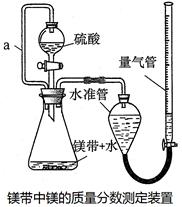
32.用离子方程式表示测定实验的反应原理。
若b为非金属元素,则以下推断正确的是_________(选填编号)。
①a一定是金属元素②d一定是金属元素③f一定是非金属元素
若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_________(选填“强”、“弱’’),能说明这一事实的化学方程式是__________________(任写一个)。
若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)。