向恒容密闭容器中充入2.0 mol A和3.0 mol B,发生反应xA(g)+2B(g)  yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:

(1)从反应开始到10 min时,该反应的平均速率v(A)= ;平衡状态I时,反应物A的转化率a(A)=__________。x:y=__________。
(2)容器内的压强:平衡状态I与起始状态相比较是__________(选填“增大”、“减小”、 “相等”或“无法判断”),逆反应为___________反应(选填“放热”或“吸热”)。
(3)推测第10 min时改变的反应条件可能是___________(选填编号)。
①减压 ②降温 ③升温 ④加催化剂 ⑤增加B的量 ⑥充入氦气
(4)若已知平衡状态I时B的物质的量为0.6 mol,平衡状态I和平衡状态Ⅱ时该反应的平衡常数分别为K1和K2。则Kl=_ ,且K1__________K2(选填“>”、“<”或“=”)。
27.氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g)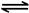 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)。
a.选择适当的催化剂b.增大压强
c.及时分离生成的NH3d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)=mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)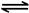 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)。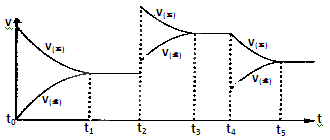
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:。
(5)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是.从理论上分析,该电池工作过程中(填“需要”或“不需要”)补充碱(KOH).
26.铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式________________________。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3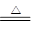 □CuSO4 +□ Cu(NO3)2+□NO↑+ □
□CuSO4 +□ Cu(NO3)2+□NO↑+ □
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为(填化学式)。
18.(共6分)现有下列浓度均为0.1 mol/L的电解质溶液:
① Na2CO3、② NaHCO3、③ 、④ CH3COONH4、⑤ NH4HCO3
、④ CH3COONH4、⑤ NH4HCO3
(1)上述5种物质的溶液既能与盐酸又能与烧碱溶液反应的是(填写序号)。
(2)已知溶液④呈中性,该溶液中离子浓度由大到小的顺序是。
(3)已知溶液⑤呈碱性,比较④、⑤两溶液的酸碱性,可以得出的结论是。
17.(共6分)金属Na、Mg、Al有广泛的应用。
(1)周期表中Na、Mg、Al所在周期是。
(2)为比较Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢。
实验2:各取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
已知:元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断。
由实验1和实验2得出的结论是,用原子结构理论解释:同周期元素从左到右,。
(3)Na、Mg、Al都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是。
21.在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图: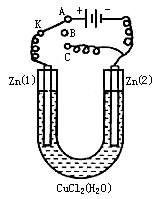
(1)如果把电键K接A,这一装置形成电解池装置,____是阳极,其电极反应式是_________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成原电池装置,________极是负极,该装置发生反应的总化学方程式是______________
(3)上述装置进行2min后,再转换电键K到B,在极上发生的腐蚀属于腐蚀。