下面是有关弱酸的电离平衡常数
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7,K2=5.6×10-11 |
结合数据,分析下列有关说法,其中错误的是
A.1mol·L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH)
B.升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大
C.0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1
D.饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是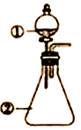
| 选项 |
①中物质 |
②中物质 |
预测②中的现象 |
| A. |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生气泡 |
| B. |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |
| C. |
氯化铝溶液 |
浓氢氧化钠溶液 |
产生大量白色沉淀 |
| D. |
草酸溶液 |
高锰酸钾酸性溶液 |
溶液逐渐褪色 |
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素X与氢形成的原子个数比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B.28g乙烯和丙烯的混合物含有的碳原子数为2NA |
| C.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA |
| D.1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
下列化合物中同分异构体数目最少的是
| A.戊烷 | B.戊醇 | C.戊烯 | D.乙酸乙酯 |
下列说法正确的是
| A.用活性炭去除冰箱中的异味是发生了化学反应 |
| B.用热碱水清除炊具上残留的油污,是因为Na2CO3可直接和油污反应 |
| C.用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |