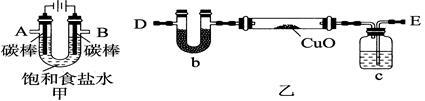
某化学小组拟采用如图所示装置(夹持和加热仪器已略去)来电解4mol/l食盐水,并用电解产生的H2还原CuO粉末,以此来测定Cu的相对原子质量。同时用产生的氢气与一氧化碳合成二甲醚。
请回答下列问题:
(1)配制本实验用到的4mol/LNaCl溶液250ml需NaCl固体质量 克,定容时俯视容量瓶将使所配溶液浓度 4mol/L(“大于”、“等于”、“小于”)
(2)为完成上述实验,正确的连接顺序为A连______________(填字母);电解发生的总的离子反应方程式为___ _____ 。
(3)通入氢气一段时间后,对硬质玻璃管里的CuO粉末加热前,需要进行的操作___________________。
(4)精确称量硬质玻璃管的质量为a g,放入CuO后,精确称量硬质玻璃管和CuO的总质量为b g,实验完毕后:通过精确称量U形管反应前后的质量,来确定生成水的质量d g,进而确定Cu的相对原子质量。利用U型管质量判断不再有水生成的方法是 本实验有明显不足之处,请指出并提出改进意见 。若不改进将使测定结果 (“偏高”、“偏低”、“无影响”)。根据以上数据计算铜的相对原子质量______________。
(1-5班必做题)某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题:
(1)A试管中发生反应的离子方程式。
(2)B试管中的现象是。
(3)该实验设计不严密,请你改正。
苯甲酸和苯甲酸钠均是食品防腐剂。某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应。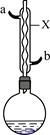
按如下流程分离出苯甲酸:
已知:① 苯甲酸熔点为122 ℃,沸点为249 ℃。
② 不同温度下苯甲酸在水中溶解度:4 ℃—0.18 g,18 ℃—0.27 g,75 ℃—2.2 g;
③
请回答下列问题:
(1)仪器X的名称是,冷却水应从口进入(填“a”或“b”)。
(2)分离苯甲酸的操作中,冰水浴冷却滤液的主要目的是,制得的苯甲酸晶体中可能含有的杂质是,为进一步提纯,应采用的方法是。
(3)芳香化合物A与苯甲酸分子式相同,A与NaOH溶液反应生成两种盐,该反应的化学方程式是。
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验。请根据下列实验回答问题: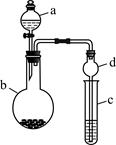
(1)甲同学用此装置验证物质的氧化性:KMnO4>Cl2>Br2,则a中加浓盐酸,b中加KMnO4,c中加_______溶液。将浓盐酸滴入b中后,发生反应的化学方程式是;b中反应结束后再向c中加入少量CCl4,振荡静置后观察到c中的现象为________。
(2)乙同学用此装置制少量溴苯,a中盛液溴,b中为铁屑和苯,c中盛水。将液溴滴入b中后,发生反应的化学方程式是:_________,。向c中滴加AgNO3溶液,可观察到的现象是____________。
(3)丙同学用上述装置制乙酸乙酯,a中加浓硫酸,b中盛装乙醇和乙酸。将浓硫酸滴入b中后用酒精灯对b缓慢加热,b中发生反应的化学方程式是;c中应盛装______溶液,其作用是______________________。
以锌铜合金的废料为原料制备硫酸铜晶体(CuSO4·5H2O)的部分工艺流程如图所示: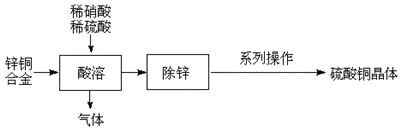
(1)酸溶时,铜转化为Cu2+的离子方程式为 ,锌铜合金要剪成碎片且反应过程要不断搅拌,其目的是 。
(2)为使酸溶后的溶液中不含NO3-,配制混酸稀溶液时,应控制硫酸与硝酸的物质的量之比不小于 。
(3)“系列操作”为 、 、过滤、洗涤、干燥。
(4)测定除锌后的溶液中Cu2+离子浓度的方法为:准确量取V1mL除锌后的溶液于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。已知: 2Cu2++4I-=2CuI↓+I2 2S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为 。
②Cu2+离子的物质的量浓度为 mol/L(用V1、V2、c表示)。
③若除锌后的溶液中仍含有NO3-离子,则测定结果会 (填“偏大”、“偏小”、“无影响”)。
过氧化钙难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:
请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用。
a.盐酸b.硝酸c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是。
(3)滤液B主要成分的化学式是。
(4)反应Ⅱ是放热反应。保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降。试分析CaO2产率下降的可能原因是。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入10 mL蒸馏水和20 mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数。
| 实验 |
1 |
2 |
3 |
4 |
| V(KMnO4) /mL |
19.50 |
21.50 |
19.48 |
19.52 |
已知:上述实验过程中反应关系为:CaO2~H2O2,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是;
(6)由表中数据可知,该样品中CaO2含量为%。若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果(填“偏高”、“偏低”或“无影响”)。