中学化学中很多“规律”都有其使用范围,据有关“规律” 下列结论合理的是
| A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B.金属钠可以通过电解熔融NaCl制得,推出金属铝可以通过电解熔融AlCl3制得 |
| C.金属钠在纯氧中燃烧生成Na2O2,推出金属锂在纯氧中燃烧生成Li2O2 |
| D.CaCO3与稀硝酸反应生成CO2,推出CaSO3也能与稀硝酸反应生成SO2 |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为()
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.下列判断正确的是 ( )
| A.一定不含Fe3+和Fe2+ |
| B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有 |
| C.溶液可能含有NO3- |
| D.一定含有Fe3+ ,但一定不含Fe2+ |
化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,ΔH的值为
| 化学键 |
Si—O |
O==O |
Si—Si |
Si—Cl |
Si—C |
| 键能kJ·mol-1 |
460 |
498.8 |
176 |
360 |
347 |
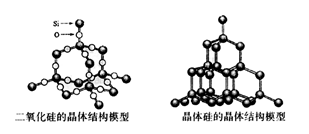
A.- 989.2 kJ·mol-1B.+ 989.2 kJ·mol-1 C.-61.2 kJ·mol-1D.-245.2 kJ·mol-1
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示: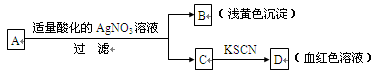
现对A、B、C、D作出的如下推断中,不正确的是
A.盐A一定是FeBr3 B.浅黄色沉淀B是AgBr
C.滤液C中一定含Fe3+ D.D溶液中有Fe(SCN)3