SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的化学方程式是 。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3):V(NaOH)= 。
② NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验):

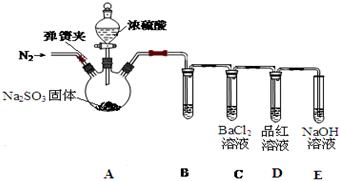
已知:Na2SO3(固体) + H2SO4(浓)  Na2SO4 + SO2↑+ H2O
Na2SO4 + SO2↑+ H2O
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
① A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
② 。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲乙两位同学的实验,得出的结论是 。
(12分)
(1)鉴别KCl溶液和K2CO3的试剂是 ;离子方程式为
(2)除去混入FeCl3溶液中少量FeCl2杂质的试剂是 ,离子方程式为.
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为。
(4)除去混入MgO少量Al2O3杂质的试剂是————————,离子方程式为——————————。
根据下面的合成路线及所给信息填空: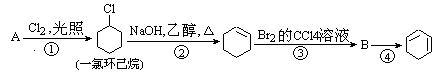
(1)A的结构简式是,名称是
(2)①的反应类型是、③的反应类型是
(3)反应④的化学方程式是
(1)氟里昂是freon的音译名,氟里昂的商业代号可用HFC—nmp表示,其中数字n等于碳原子数目减1(如果是0就省略),数字m等于氢原子数目加1,数字p等于氟原子数,氯原子数目不列。则氟里昂CH2F-CHF2的代号为,它属于(填“一卤代烃”“多卤代烃”“不饱和卤代烃”“芳香卤代烃”)类有机物,其同分异构体的结构简为;
⑵由于氟里昂无毒,化学性质又极其稳定,被大量用于制冷剂、灭火剂、发泡剂等。但大气中的氟里昂在平流层中受紫外线照射,会分解产生Cl原子,而Cl原子化学性质比较活泼: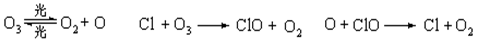
上述反应的总反应为,反应过程中,Cl原子起作用;
⑶O3和O2的关系是;
A.同分异构体 B.同系物 C.氧的同素异形体 D.氧的同位素
⑷近几年市面上推出的冰箱新产品---无氟冰箱,主要是为了。
A.氟里昂价格高,为了经济 B.保护生态环境
C.保护人类生存环境 D.吸收和阻挡紫外线
家用不粘锅的表面涂有一层物质,它是聚四氟乙烯,请写出合成此聚合物的单体是。
抗酸药主要用于治疗____________的疾病。用离子方程式表示“胃舒平” (主要成份是氢氧化铝)治疗胃酸过多的原理_____________________________