某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |
|
|

测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化的离子方程式为____________________
(3)实验①和②的结果表明________________;实验①中0~t1时间段反应速率v(Cr3+)=________________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:____________________;
假设三:____________________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
(15分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: ; 。
(2)试剂X是 。由溶液D是 。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因 。
(5)用固体F继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;写出反应的化学方程式 ,
(6)工业上常用溶液E经进一步处理可制得净水剂Na2FeO4,流程如下:
①测得溶液E中c(Fe2+) 为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25 % 的H2O2溶液___kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式______ _____。
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。
D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。
(2)需在方框中画出 装置, 装置(只填写,不画图)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有: 。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是 (填序号,不定项选择)
A.CO2
B.NH3
C.O3
D.N2
E.NO2
SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:①沉淀洗涤要干净,检验洗涤已经干净的实验操作是 。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示) 。
海水中含有非常丰富的化学资,从海水中可提取多种化工原料。下图是某工厂对海水资综合利用的示意图。
试回答下列问题:
(1)我国规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,方法是将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液,合理的操作顺序是 (填序号)。
(3)写出电解饱和食盐水的化学方程式 ,当转移0.2mol电子时,阴阳两极生成的气体体积之和是 (标准状况下)。
(4)以海边贝壳为原料可以制取石灰乳,贝壳的主要化学成分为 (写化学式)。
(5)目前,世界上生产的镁有60%自海水,由“母液”制“镁”的过程中,发生了 个复分解反应(填数目)。
(6)电解氯化镁所得的氯气,除用于生产盐酸外,还可以用于制取漂白粉,漂白粉的有效成份是 (写化学式)。
(7)溴主要以Br-形式存在于海水中,提取食盐后剩下的母液(也叫卤水)中,Br-的浓度较大,工业上 制备的Br2的操作步骤为:一定条件下,将Cl2通入卤水中,生成Br2,利用热空气将Br2吹出,Br2可用热空气吹出,其原因是 。
(10分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。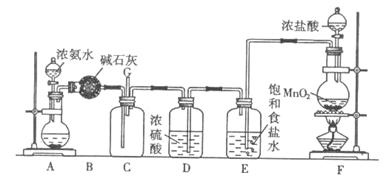
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂为 。
(3)B装置的名称是 ; E装置的作用是 。
(4)通入C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(a、b的代数式表示) 。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理? 。
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。
(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、氯化铵 |
反应的化学方程式为 ① |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____ ,硬质玻璃管中氨发生催化氧化反应的化学方程式为 。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为 ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有 。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。