实验室制取少量N2常利用的反应是NaNO2+NH4Cl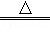 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
| A.NaNO2是氧化剂 |
| B.生成1molN2时转移的电子为6mol |
| C.NH4Cl中的N元素被还原 |
| D.N2既是氧化剂又是还原剂 |
下列化合物跟溴和铁粉反应,氢原子被取代,所得一溴代物C8H9Br有二种同分异构体的是
A. |
B. |
C.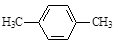 |
D. |
对氟里昂的有关叙述正确的是()
| A.有两种同分异构体 | B.是平面型分子 |
| C.是一种温室气体 | D.在高空可破坏臭氧层 |
下列叙述正确的是()
| A.苯的分子是环状结构,其性质跟环烷烃相似 |
| B.苯分子的结构中含有碳碳双键,因此苯的性质跟烯烃相同 |
| C.苯的分子式为C6H6,分子中的氢原子远远没有饱和,因此能和溴水反应 |
| D.苯不能使酸性KMnO4溶液褪色,而大多数苯的同系物却可以使酸性KMnO4溶液褪色 |
X、Y、Z三种气体,把a mol X与b mol Y充入一密闭容器中,发生反应X+2Y 2Z.达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
2Z.达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
A. ×100% ×100% |
B. ×100% ×100% |
C. ×100% ×100% |
D. ×100% ×100% |
乙醇分子中不同的化学键如图所示,关于乙醇有关性质的说法不正确的是()
| A.和金属钠反应键①断裂 |
B.在铜催化下和O2反应键①④断裂 |
| C.乙醇与金属钠反应比水与金属钠反应缓慢 |
| D.钠与乙醇反应时,钠熔化成一个小球在乙醇表面不断的游动 |