室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol•L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是:
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4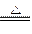 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是()
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是()
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.H2C2O4的氧化性强于ClO2的氧化性 |
| D.1mol KClO3参加反应,转移的电子为1mol |
近年来赤潮在我国时有发生,当赤潮发生时,海水中的某些微小浮游生物大量繁殖,使水体呈红、紫等颜色,并对生物造成危害。下列说法中不正确的是()
| A.赤潮是水体富营养化的结果 |
| B.含磷洗涤剂广泛使用与排放是发生赤潮的主要原因之一 |
| C.在封闭的海湾更易发生赤潮 |
| D.赤潮的发生是与人类活动无关的自然现象 |
为减少大气污染,北京市公共汽车已逐步使用CN G清洁燃料,实验测得1.6 g该气体燃料,完全燃烧生成2.24 LCO2(标准状况)和3.6 g液态水,并放出89.03 kJ的热量。下列说法正确的是()
| A.CN G的化学式为CH4O |
| B.CN G的燃烧热为890.3 kJ·mol-1 |
| C.CN G的化学式为C4H1O |
| D.CN G的燃烧热为890.3 kJ |
煤、石油、天然气和生物能作为能源的共同特点是()
| A.可再生能源,取之不尽,用之不竭 |
| B.不可再生能源,用一点,少一点 |
| C.来自太阳辐射的能量 |
| D.污染环境的能源 |
凡是能够提供某种形式的能量的物质,或是物质运动,统称为能源。“能源分类相关图”如图2-19所示,四组能源选项中,全部符合图中阴影部分的能源是()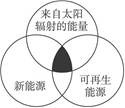
图2-19
| A.煤炭、石油、潮汐能 |
| B.水能、生物能、天然气 |
| C.太阳能、风能、沼气 |
| D.地热能、海洋能、核能 |