在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+3Y(g) 4Z(g),此反应达到平衡的标志是
4Z(g),此反应达到平衡的标志是
| A.容器内压强不随时间变化 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶3∶4 |
| D.单位时间消耗0.1 mol X同时生成0.4mol Z |
稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得。 |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
C.铈溶于氢碘酸的化学方程式为:Ce +4HI CeI4+2H2↑ CeI4+2H2↑ |
D.四种稳定的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce它们互称为同素异形体 Ce它们互称为同素异形体 |
关于物质分类或归类正确的是
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥胶体:碘酒、牛奶、豆浆、漂粉精
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯
| A.①③④ | B.②③④ | C.只有③④ | D.②④⑥⑦ |
将铁粉和铜粉的均匀混合物,平均分为四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)
| 编号 |
① |
② |
③ |
④ |
| 稀硝酸体积/ml |
100ml |
200ml |
300ml |
400ml |
| 剩余金属/g |
18.0g |
9.6g |
0 |
0 |
| NO体积/L |
2.24L |
4.48L |
6.72L |
V |
经化学定量分析,下列推断正确的是
A.硝酸的浓度为4mol/L B.①中溶解了5.6gFe
C.②溶液有Cu2+和Fe3+D.④中V = 6.72L
向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是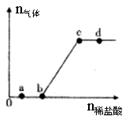
| A.a点对应的溶液中:Na+、OH-、SO42-、NO3- |
| B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl- |
| C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
保持恒温、恒容,在某密闭容器中发生反应:2A(g)+2B(g)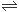 C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ——从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ——从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ——从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ——从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
A.Ⅰ、Ⅱ两种途径从反应开始到平衡状态所消耗的时间相同
B.Ⅰ、Ⅱ两种途径最终达到平衡时,体系的总压强相等
C.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的物质的量分数相同
D.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的浓度相同