某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示。
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 |
CO32-、AlO2-、NO3- |
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。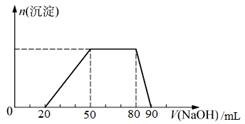
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示。
| Cl2的体积(标准状况) |
5.6L |
11.2L |
22.4L |
| n(Cl-) |
2.5mol |
3.0mol |
4.0mol |
| n(Br-) |
3.0mol |
2.8mol |
1.8mol |
| n(I-) |
X mol |
0 |
0 |
下列说法中错误的是
A.X=0.3
B.溶液中n(Cl-): n(Br-):n(I-)=10:15:4
C.加入的氢氧化钠溶液的浓度为1.45mol·L-1
D.溶液中大量存在的离子共有六种
SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为
| A.6种 | B.7种 | C.10种 | D.12种 |
下列分子中所有原子都满足最外层8电子结构的是
| A.光气(COCl2) | B.六氟化硫 | C.二氟化氙 | D.三氟化硼 |
石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面网状结构,如果将每对相邻碳原子间的短线看成一个化学键,则石墨晶体中每一层内碳原子数与C—C键数的比是
| A.2∶3 | B.1∶3 | C.1∶1 | D.1∶2 |
下列有关杂化轨道的说法不正确的是
| A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道 |
| B.轨道数目杂化前后可以相等,也可以不等 |
| C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原理 |
| D.杂化轨道可分为等性杂化轨道和不等性杂化轨道 |
在乙烯分子中有5个σ键、一个π键,它们分别是
| A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |