下列说法正确的是
| A.把SO2通入酸性高锰酸钾溶液,即可验证SO2的漂白性 |
| B.无论是在0.1mol·L-1的CH3COOH溶液中加水稀释,还是加入少量CH3COONa晶体,都会引起溶液的导电能力减弱 |
| C.实验室需用480mL 0.1mol·L-1硫酸铜溶液,应称取12.5g胆矾晶体,并用500mL容量瓶定容配制 |
| D.硫酸亚铁铵晶体中NH4+的检验操作为:取适量样品置于试管中加水溶解,滴加少量稀氢氧化钠溶液,并将湿润的红色石蕊试纸靠近试管口,试纸变蓝则存在NH4+,反之则不存在NH4+ |
设NA表示阿伏加德罗常数,下列说法不正确的是
A.甲烷的摩尔质量与NA个甲烷分子的质量在数值上相等
B.NA个氧气分子和NA个氢气分子的质量比为16∶l
C.28g氮气所含的原子数目为2NA
D.由D与18O组成的水10g所含的中子数为12NA
“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是
| A.溶液的性质 | B.胶体的性质 | C.浊液的性质 | D.无法确定 |
上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
| A.无机物 | B.有机物 | C.盐类 | D.非金属单质 |
16.某实验小组对一含有Al3+的未知溶液 进行了如下分析:①滴入少量氢氧化钠溶液,无明显变化;②继续滴加氢氧化钠溶液,开始产生白色沉淀;③滴入过量的氢氧化钠溶液,白色沉淀明显减少。实验小组经定量分析,绘出沉淀的物质的量与滴入氢氧化钠体积的关系图:
进行了如下分析:①滴入少量氢氧化钠溶液,无明显变化;②继续滴加氢氧化钠溶液,开始产生白色沉淀;③滴入过量的氢氧化钠溶液,白色沉淀明显减少。实验小组经定量分析,绘出沉淀的物质的量与滴入氢氧化钠体积的关系图: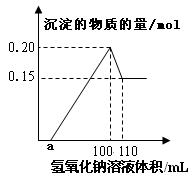
则下列说法中错误的是()
| A.该未知溶液中至少含有3种阳离子 |
B.滴加的NaOH溶液的物质的量浓度为5 |
| C.若另一种离子为二价阳离子,则a="10" |
| D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g |
15.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H= +64.39kJ·mol-1
②2H2O2(l)=2H2O (l)+O2(g)△H= -196.46kJ·mol-1
(l)+O2(g)△H= -196.46kJ·mol-1
③H2(g)+O2(g)=H2O(l)△H= -285.84kJ·mol-1
下列有关说法错误的是( )
| A.铜可以溶解于稀盐酸与H2O2的混合溶液 |
| B.铜溶解于酸性双氧水的热化学方程式为: Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68 kJ·mol-  1 1 |
| C.反应①是在任何条件下都不可能发生的化学反应 |
| D.用H2O2和H2SO4的混合溶液溶解铜比用浓硫酸溶解铜环保 |