某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。

请填写下列空白:
(1)图中试剂1是________,试剂2是________。试剂4最好是________。
(2)步骤1和步骤2所用到的玻璃仪器是________________。
(3)步骤1反应的离子方程式为________________________。
(4)步骤5反应的离子方程式为________________________。
(5)Al(OH)3可用以下三种途径制备
①Al NaAlO2
NaAlO2 Al(OH)3 ②Al
Al(OH)3 ②Al Al2(SO4)3
Al2(SO4)3 Al(OH)3
Al(OH)3
③
上述三途径制备Al(OH)3你认为最佳途径是 ,理由是 。
在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示: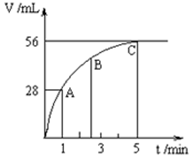
(1)该反应还可用____________代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为_____________________。试解释反应速率变化的原因是___________________。
(3)该H2O2水溶液的物质的量浓度为____________________。
现有A、B、C三种烃,A是B分子中的所有氢原子被C的一价取代基(即烃分子失去一个氢原子后剩余的部分)取代的产物。
已知:
① A不能使溴的CCl4溶液褪色,其一氯代物只有一种。
② 一定量的B完全燃烧,将产物依次通过盛有CaCl2和碱石灰的干燥管,测得质量增重分别为3.6g和17.6g;且26g/mol<M(B)<78g/mol。
③ C为饱和链烃,通常情况下为气态,其同分异构体不超过2种,二溴代物有3种。
回答下列问题:
(1)B的最简式是_______,写出B的一种链状同分异构体的结构简式_________(要求:所有原子在同一平面内,所有碳原子不处于同一直线上)。
(2)C的分子式为_______,其一溴代物在氢氧化钠醇溶液和加热条件下可以发生反应,则反应后有机产物的名称为_______________。
(3)B分子的所有氢原子被硝基取代后的产物为一种新型炸药,该炸药爆炸分解产生无毒的物质,写出该爆炸反应的化学方程式__________________。
(1)请用下面的A-D字母填空:①由乙醇制乙烯;②乙醛的银镜反应:
| A.直接加热 | B.垫石棉网加热 | C.水浴加热 | D.不需要加热 |
(2)既不属于取代反应也不属于消去反应的有机反应是(反应条件未注明)____(填序号)
① Fe + 2HCl = FeCl2 + H2↑
② CH2=CHCH3 + Cl2 →CH2=CHCH2Cl + HCl
③ 2CH3CH2OH→CH3CH2OCH2CH3+ H2O
④ CH3CH2Br + NaOH→CH2=CH2+NaBr + H2O
⑤ 2CH3CHO + O2→CH3COOH + H2O
⑥
(3)按系统命名法:
① CH2=C(C2H5)(CH2)2CH(CH3)C(CH3)3的名称为___________________。
② CH3CH2CH2OH的名称为_________________。
(4)仔细观察下列有机物,该系列有机物中第n个分子的分子式为__________;二十八星烷中碳的百分含量为_______。
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为;
(3)计算该反应的平衡常数K=。
(4)①反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)="0.9" mol/L。第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的极(填“正”或“负”),该电极反应式为。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是_____L。
已知T℃、P kPa时,在容积为V L密闭容器内充有1 mol A和1 mol B.保持恒温恒压,使反应:A(g)+B(g)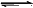 C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2 mol C,则反应达到平衡时,容器的容积为___________,C的体积分数为_________。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1 mol A和1 mol B反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为_________。