100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。
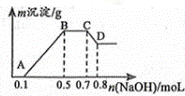
则(1)溶液中一定含有的阳离子有 ,一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为 mol•L﹣1和 mol•L﹣1
在配制Al2(SO4)3溶液时,为了防止发生水解,可加入少量的;在配制Na2S溶液时,为了防止发生水解,可加入少量的;把AlCl3溶液蒸干后再灼烧,最后得到的主要固体产物是。其理由是(用化学方程式表示,)
、。
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5min内,消耗H2的平均反应速率为___________________________________
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值(填变大、变小、不变),正反应速率(填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度0.4 mol·L—1(填大于、小与、等于)
溶液配制及滴定:
(1)配制一定物质的量浓度的稀硫酸。
用24.5%硫酸(密度为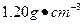 )配制100 mL 0.200
)配制100 mL 0.200 硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先,再用来量取所需的硫酸。
硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先,再用来量取所需的硫酸。
(2)用已配好的0.200 的硫酸溶液测定氢氧化钠样品中杂质氯化钠的含量。
的硫酸溶液测定氢氧化钠样品中杂质氯化钠的含量。
准确称取2.0克混有氯化钠的氢氧化钠固体试剂,将其配成100mL待测溶液,用浓度为0.200mol/L的标准硫酸酸溶液进行滴定,三次滴定的记录数据如下
| 实验编号 |
滴定开始时滴定管的读数为 |
滴定完成时,滴定管的读数为 |
待测溶液的体积 (mL) |
| 1 |
0.07 |
22.59 |
20.00 |
| 2 |
0.22 |
22.72 |
20.00 |
| 3 |
0.35 |
22.83 |
20.00 |
测定出的氢氧化钠质量分数为 。
某学生设计了如下实验: 回答下列问题:
回答下列问题:
(1)该同学的实验目的是;
(2)上图括号内的操作步骤均为;
(3)按此实验方案得到的NaCl固体中肯定含有(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的(填物质的名称);
(4)写出生成B的离子方程式
(1)向硫酸氢钠溶液中,逐滴加入Ba(OH)2溶液至中性。请写出发生反应的化学方程式:;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式;