含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)与A同族但相对原子质量比A小的元素B的原子结构示意图为 .
(2)C与氢氟酸反应的化学方程式是 .
(3)将C与纯碱混合高温熔融时反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,生成了含A的化合物F.
①生成D和F的化学方程式分别为 、 .
②要将纯碱高温熔化,下列坩埚中可选用的是 .
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚.
(1)现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
(2)0.1mol/L的NaHCO3溶液中,按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外),c(Na+)+c(H+)=_______________,c(Na+)=____________
(1)氯化铝水溶液呈性,其离子方程式表示为;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(2)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为;
此反应每转移2mol电子消耗的O2在标准状况下的体积为L。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下图方框中画出能够实验这一反应的装置图(作必要的标注);
某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是。
某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象。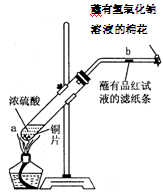
回答下列问题:
(1)写出试管中发生反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)蘸有NaOH溶液的棉花团作用是。
(4)硫酸型酸雨的形成过程可用下列反应中的来表示。
A:SO2+H2O H2SO3
H2SO3
B:O2+2H2SO3=2H2SO4
C:SO2+H2O2=H2SO4
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中物质E是气体丙的水溶液,物质H是红褐色沉淀。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。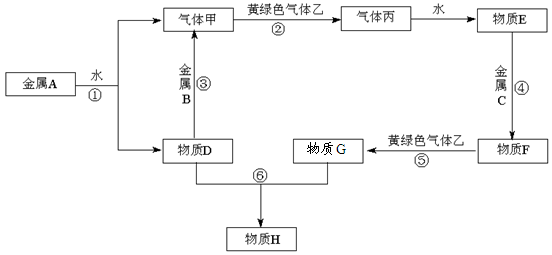
请根据以上信息回答下列问题:
(1)写出A、C、丙的化学式:
A、 C、丙
(2)写出反应③的化学方程式:,
反应⑤的离子方程式:。
已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步:第三步:;
(2)待测液中一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。