现有一定体积的HCl气体,将其溶于100 mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4 mol·L-1的NaOH溶液10 mL恰好呈中性。继续向所得中性溶液中滴入过量的Ba(OH)2溶液,所得沉淀质量为2.33 g。
(1)写出生成沉淀的离子方程式
(2)计算硫酸的物质的量浓度。
(3)计算该HCl气体在标准状况下的体积。
(4)若向该混酸溶液(仍为100 mL)中加入Na2CO3·10H2O晶体,直到不再产生气体时为止,计算消耗Na2CO3·10H2O晶体的质量。
(8分)将18gMg投入2000ml稀盐酸中恰好完全反应,试计算:
(1)标准状况下,反应中生成气体体积是多少升?
(2)稀盐酸的物质的量浓度是多少?
A、 B两种气态烃,标准状况下A的密度为1.25g/L。将总质量为4.4g的A、B混合气体4.4
B两种气态烃,标准状况下A的密度为1.25g/L。将总质量为4.4g的A、B混合气体4.4 8L(标准
8L(标准 状况)通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了2.8g,求A、B是什么气体?
状况)通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了2.8g,求A、B是什么气体?
取25g CuSO4.5H2O溶于水配成100ml溶液
(1)计算CuSO4的物质的量浓度
(2)取20ml 该 溶液用水稀释,使CuSO4的物质的量浓度变为0.08mo
溶液用水稀释,使CuSO4的物质的量浓度变为0.08mo l/L,应该使用多大规格的容量瓶?
l/L,应该使用多大规格的容量瓶?
由铜片、锌片和100mL稀硫酸溶液组成的原电池中,当铜片上产生2.24L(标态)气体时,硫酸恰好作用完,试计算:
⑴锌片质量减轻了克⑵原稀硫酸溶液的物质的量浓度是
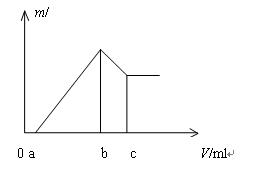
将镁、铝的混合物0.1 mol 溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:(1)当a =" 160" mL时,金属混合物中n(Mg)=mol,n(Al)=mol,c =mL;(2)若欲使Mg2+、Al3+刚好完全沉淀,则加入的NaOH的体积V应为多少毫升?