下列反应中Na2O2,只表现强氧化性的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.Na2O2+MnO2=Na2MnO4 |
| C.2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑ |
| D.5Na2O2+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4+8H2O+5O2↑ |
下列有关化学平衡常数K的说法中,正确的是
| A.K的大小与起始浓度有关 |
| B.温度越高,K值越大 |
| C.K值越大,反应正向进行的程度越大 |
| D.K值越大,反应正向进行的程度越小 |
下列说法正确的是
| A.放热反应一定不需要加热 |
| B.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生 |
| D.难溶物也可能是强电解质 |
中和热的测定实验中,可能用到下列仪器:
①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯。
其中应使用仪器的正确组合是
| A.①②⑤ | B.②③④ | C.②③⑥ | D.全部 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是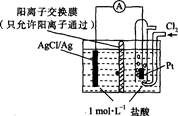
| A.正极反应为AgCl+e-═Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
一定条件下,2SO2(g)+O2(g) 2SO3(g)△H<0,有关叙述正确的是
2SO3(g)△H<0,有关叙述正确的是
| A.升高温度,v(正)变大,v(逆)变小 |
| B.恒温恒容,充人O2,02的转化率升高 |
| C.恒温恒压,充人N2,平衡不移动 |
| D.恒温恒容,平衡前后混合气体的密度保持不变 |