2008年9月25日21时10分,我国在酒泉卫星发射基地成功发射神舟七号宇宙飞船,实现了中国航天航空史上的伟大突破。承载神舟七号升空任务的是长征二号F型火箭,其第一节、第二节、第三节均以液态四氧化二氮(N2O4)和联氨(N2H4)为原料,使后者在前者中燃烧,产生巨大的推动力助火箭升空,最终产物是N2和H2O。
(1)请写出该反应的化学方程式_______________________;
(2)反应中氧化剂是____________________;
(3)该反应属于_______________(填“放热反应”或“ 吸热反应”)。
(1)碳酸钾的水溶液蒸干得到的固体物质是________,原因是________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是________,原因是____________________。
(3)碳酸氢钡溶液蒸干得到的固体物质是________,原因是____________________。
(4)亚硫酸钠溶液蒸干得到的固体物质是________,原因是____________________。
(5)氯化铝溶液蒸干得到的固体物质是________,原因是______________________。
将等体积的氨水与盐酸溶液混和后,若混和溶液中[NH ]=[Cl-],则溶液中的pH值为______7,混和前[NH3·H2O]______[HCl],氨水中[OH-]______盐酸中[H+]。(填>、<或=,下同)
]=[Cl-],则溶液中的pH值为______7,混和前[NH3·H2O]______[HCl],氨水中[OH-]______盐酸中[H+]。(填>、<或=,下同)
某温度下0.1mol/L Na2CO3溶液中,[Na+]/[CO32—]=20/9>2,其原因是____________,现向Na2CO3溶液中通入一定量的CO2后,[Na+]/[CO32—]=5/2>20/9,其原因是_________,此时[HCO3—]=_____________。
由碳、氢、氧三种元素组成的某有机物X的相对分子质量为136,其中碳、氢元素的质量分数之和为76.5﹪.又知X中含有甲基,苯环上的一氯代物有两种。X经热的酸性KMnO4溶液处理后转化为Y,1mol Y与足量NaHCO3溶液反应生成标准状态下44.8L CO2气体。
据此完成下列要求。
(1)X中含氧官能团的名称为,1mol Y最多可与mol Na反应。
(2)已知A、B、C、D均与X互为同分异构体,且均是有一个取代基的芳香族化合物,其中B可以发生银镜反应。相关转化关系如下图。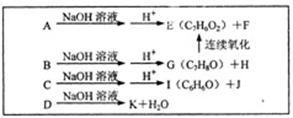
①A的结构简式为。A~K的各有机物中,属于酸的是(填字母)。
②C与足量的NaOH溶液加热时发生反应的化学方程式为:,该反应中涉及到的有机反应类型为。
③属于芳香族化合物的E的同分异构体有种(不含E)。
④足量的G与Y在一定条件下发生反应的化学方程式为:。
某固体混合物X可能由Na2O2、Al2O3、Fe2O3、 Cu 、SiO2中的一种或几种物质组成。为确定X的成分,进行了如下三个试验。分析并回答下列问题:
(1)由试验①可得出的结论为:。
(2)步骤Ⅰ所发生反应的离子方程式为:,。反应Ⅱ涉及固体质量变化的化学方程式为:。
(3)由步骤Ⅲ可得出的结论为:。
(4)步骤Ⅳ所得蓝色溶液中阳离子为。
(5)原混合物中各成分的质量之比是。(不必简化)