某温度下,在一个2L的密闭容器中加入4molA和2molB进行如下反应:
3A(g) + 2B(g)  4C(s) + D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s) + D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
A.该反应的平衡表达式是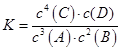  |
| B.B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡正向移动,B的平衡转化率增大 |
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素.其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外).W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是
| A.Y的简单离子半径小于Z的简单离子半径 |
| B.Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
| C.Y的简单气态氢化物在一定条件下可被Q单质氧化 |
| D.Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
下列说法正确的是
| A.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
| B.司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
| C.聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 |
| D.用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 |
下列离子在指定条件下能大量共存的是
| A.能使石蕊试液显红色的溶液中:NH4+、Fe 2+、Al3+、NO3- |
| B.加入NH4HCO3能产生气体的溶液中:K+、Na+、I-、SO42- |
| C.中性透明溶液中:K+、HCO3-、NO3-、Fe3+ |
| D.常温下由水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- |
下列离子方程式书写正确的是
A.用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH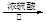 CH2=CHCH=CH2↑+ HBr↑+H2O CH2=CHCH=CH2↑+ HBr↑+H2O |
| B.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| C.向CuSO4溶液中滴加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ |
| D.用侯氏制碱法制得NaHCO3 :Na++NH3+CO2+H2O =NaHCO3↓+NH4+ |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
| A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA |
| B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA |
| C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA |
| D.lmolFe在氧气中充分燃烧失去3NA个电子 |