某溶液中可能含有下列离子: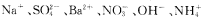 中的某几种离子,为确定该溶液的组成,某同学做了如下实验:
中的某几种离子,为确定该溶液的组成,某同学做了如下实验:
(1)取少量上述溶液,向其中加入硫酸钠溶液,产生白色沉淀,加入稀硝酸沉淀不溶解;
(2)另取少量该溶液,向其中加入足量的NaOH溶液并加热,产生有刺激性气味的气体。则下列有关说法中不正确的是
A.该溶液中一定含有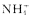 |
| B.该溶液中一定含有硝酸根离子 |
C.该溶液中一定含有 |
D.根据上述实验不能确定 是否存在 是否存在 |
在下列实验中,不能达到目的的是
| A.用NaHCO3鉴别低级醇和低级羧酸 |
| B.用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱 |
| C.将氯化铁固体溶解在少量浓盐酸中,然后稀释得到氯化铁溶液 |
| D.淀粉作指示剂,用已知浓度的碘水滴定未知浓度的FeCl2溶液测定其物质的量浓度 |
某黄色溶液含有下列离子中的几种:Ag 、NH4
、NH4 、Fe3
、Fe3 、SO3
、SO3 、HCO3
、HCO3 、Br
、Br 、
、
SCN ,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
A.溶液中不存在大量HCO3 和SCN 和SCN |
| B.溶液中一定存在大量Fe3+ |
C.溶液可能含有Ag |
D.溶液中可能存在NH4 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3Sn2+ + 18Cl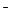 + aH3AsO3 + bH+=aAs + 3SnCl6
+ aH3AsO3 + bH+=aAs + 3SnCl6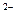 + cM,关于该反应的说法中正确的组合是
+ cM,关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3; ② 还原性:Cl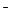 >As; ③ 每生成0.1 mol As,还原剂失去的电子为0.3mol; ④ M为OH
>As; ③ 每生成0.1 mol As,还原剂失去的电子为0.3mol; ④ M为OH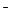 ; ⑤ a=2,b=6
; ⑤ a=2,b=6
| A.只有①③ | B.①③⑤ | C.①②③④ | D.①②④⑤ |
关于下列各比较对象,前者一定大于后者的是
A.将pH均为11的NaOH溶液和氨水溶液分别稀释成pH=10的溶液,所加水的量
B.物质的量浓度相等的Na2CO3溶液与(NH4)2CO3溶液中CO3 的物质的量浓度
的物质的量浓度
C. 常温下pH=5的NaHA溶液中c(H2A)与c(A )
)
D. 等浓度的氯化钠和苯酚钠溶液中水的电离程度
下列有关叙述正确的是
| A.纤维素的水解产物能够发生银镜反应,说明纤维素是还原性糖 |
| B.纯碱、氯仿(CHCl3)、蔗糖、植物油在一定条件下都可以发生水解 |
| C.工业上通过电解AlCl3饱和溶液制备金属铝 |
| D.SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |