某溶液可能含有Clˉ、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
由此可知原溶液中
| A.至少存在5种离子 |
| B.Clˉ一定存在,且c(Clˉ)≥0.4mol/L |
| C.SO42ˉ、NH4+、一定存在,Clˉ可能不存在 |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( ) 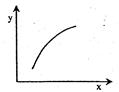
| 选项 |
x |
y |
| A |
降温 |
A的体积分数 |
| B |
升高温度 |
混合气体的密度 |
| C |
再加入A |
B的转化率 |
| D |
再加入C |
A的体积分数 |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.碱性溶液中:ClO-、Cl-、K+、Na+ |
| B.常温常压下气体:O2、N2、Cl2、NH3 |
| C.含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D.氢氧化铁胶体: H+、K+、S2-、Br- |
实验室中制取、洗气并收集气体的装置如图所示。仅用此该装置和表中提供的物质完成相关实验,最合理的选项是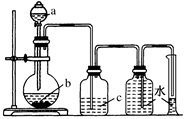
| 选项 |
a中的液体 |
b中的固体 |
c中液体 |
| A |
浓盐酸 |
MnO2 |
饱和食盐水 |
| B |
浓氨水 |
生石灰 |
浓H2SO4 |
| C |
浓硫酸 |
Cu片 |
NaOH溶液 |
| D |
稀HNO3 |
Cu片 |
H2O |
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 |
| B.CaCN2中含有非极性键 |
| C.HCN既是氧化剂又是还原剂 |
| D.每消耗10g CaCO3生成2.24L CO2 |
下列离子方程式书写正确的是
| A.碳酸氢钠与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| C.钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu |
| D.碳酸氢钠溶液中加入烧碱溶液:HCO3-+OH-=CO32-+H2O |