工业上用铝土(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程: 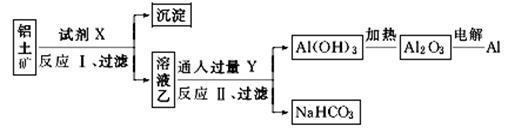
对上述流程中的判断正确的是
①试剂X为稀硫酸,沉淀中含有硅的化合物
②反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-+2H2O===Al(OH)3↓+HCO3-
③结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32-
④Al2O3熔点很高,工业上还可采用电解熔融AlCl3的方法冶炼Al
| A.①② | B.②③ | C.①④ | D.③④ |
下列化学实验有关的叙述正确的是( )
| A.某无色溶液中滴加BaCl2溶液出现白色沉淀,说明该无色溶液中一定含有SO42— |
| B.向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,生成黄色沉淀,说明Ksp(AgI)比Ksp(AgCl)大 |
| C.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜熔点高于铝 |
| D.SO2、Cl2都能使品红试液褪色,其原理是相同的 |
用下列实验装置进行的实验中,能达到相应实验目的的是( )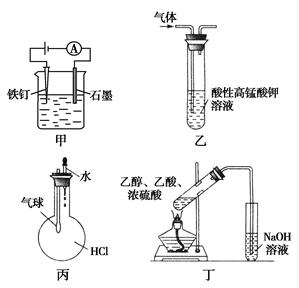
| A.装置甲:为防止铁钉生锈 |
| B.装置乙:除去一氧化碳中混有的乙烯 |
| C.装置丙:验证HCl气体在水中的溶解性 |
| D.装置丁:实验室制取乙酸乙酯 |
下列实验操作与预期实验目的或实验结论不一致的是( )
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
可证明氧化性:H2O2比Fe3+强 |
| B |
在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 |
验证盐类水解反应是吸热反应 |
| C |
将一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 |
得到NaCl晶体 |
| D |
苯酚钠溶液中通入足量二氧化碳产生浑浊 |
苯酚的酸性弱于碳酸 |
有一无色透明溶液,可能含有Na+,Al3+,Mg2+,Fe3+,NH4+,Cl-,SO42—,HCO3—中的几种,取该溶液三份分别进行实验:①滴加甲基橙溶液显红色;②逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解;③加入5 mL 0.1 mol·L-1 BaCl2溶液至不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.2 g沉淀。由此推知,原溶液中( )
| A.一定有Al3+,Mg2+,Cl-,SO42— |
| B.一定没有Mg2+,Fe3+,HCO3— |
| C.不能确定是否含有Cl- |
| D.可能有Na+,NH4+,Cl-,SO42— |
下列叙述正确的是( )
| A.丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B.氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C.实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D.测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |