常温下,下列各组离子在制定溶液中一定能大量共存的是
| A.在pH =12溶液中:Na+、Ca2+、HCO3 −、ClO− |
| B.在能使石蕊变红的溶液中:Mg2+、K+、Br−、SO42 − |
| C.在0.1mol ·L−1的NaHCO3溶液中:K+、Al3+、I−、Cl− |
| D.在与Al 反应能放出H2的溶液中: Fe2+、K+、NO3−、SO42 − |
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
据中国储能网讯2012年8月23日报道,锂离子电池常见的正极材料主要成分为LiCoO2,负极则是特殊分子结构的碳.电解质为能传导Li+的高分子材料,充电时,加在电池两极的电势迫使正极的化合物释出锂离子,嵌入负极分子排列呈片层结构的碳中,这种锂离子电池的电池反应为:Li(C)+LiCoO2 Li2CoO2,下列说法不正确的是
Li2CoO2,下列说法不正确的是
A.该电池属于二次电池
B.充电时LiCoO2既发生氧化反应又发生还原反应
C.填充在正负极之间的电解质,除了保持稳定,还需要具有良好导电性,减小电池内阻
D.放电过程中Li+向负极移动
下列叙述中,不正确的是
| A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10 |
| B.1.0mol/ L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C.仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在: c(Na+)>c(CH3COO-) >c(OH-)>c(H+) |
| D.0.1mol/ L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/ L |
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下: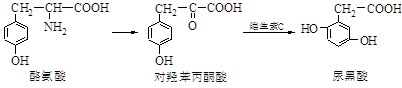
下列说法错误的是
| A.酪氨酸的分子式为C9H11O3N |
| B.对羟苯丙酮酸分子中有三种含氧官能团 |
| C.可用溴水鉴别对羟苯丙酮酸与尿黑酸 |
| D.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应 |
下列说法正确的是
| A.高熔点的固体如果不是离子晶体,则一定为原子晶体 |
| B.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| C.由两种元素组成的共价化合物分子中,只可能存在极性键 |
| D.若X+ 和Y2-的核外电子层结构相同,则原子序数:X>Y |