下列是几种原子的基态电子排布,电负性最大的原子是
| A.1s22s22p4 |
| B.1s22s22p63s23p3 |
| C.1s22s22p63s23p2 |
| D.1s22s22p63s23p64s2 |
由两种气态烃组成的混合烃的总物质的量与该混合烃充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如右图所示;以下对混和烃组成的判断中正确的是
| A.一定有乙烯 | B.一定有甲烷 |
| C.一定有丙烷 | D.一定没有乙烷 |
在烃分子中去掉2个氢原子变成碳碳双键是吸热反应,而1,3-环己二烯失去了2个氢原子,变成苯是放热反应,结合以上信息判断下列叙述正确的是
| A.1,3-环己二烯比苯稳定 |
| B.苯比1,3-环己二烯稳定 |
| C.1,3-环己二烯加氢是吸热反应 |
| D.苯与氢气加成生成环己烷是吸热反应 |
下列说法错误的是
| A.某有机物燃烧只生成CO2和H2O,则该有机物一定只含碳和氢 |
| B.乙醇可以与水任意比互溶,是因为乙醇与水形成了氢键 |
| C.不存在两种邻二甲苯,因此现代结构理论认为苯分子中碳碳键不是单双键交替 |
| D.煤的干馏、石油分馏和裂化都是物理变化 |
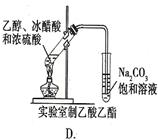
下图中所示的实验方法、装置和操作正确的是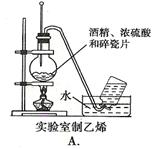


一定量乙醇在氧气不足时燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是
| A.4.4 g | B.1.4 g | C.2.2 g | D.在2.2 g和4.4 g之间 |