有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是
途径①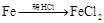 溶液 途径②
溶液 途径②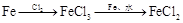 溶液
溶液
途径③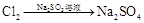 溶液 途径④
溶液 途径④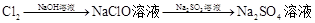
途径⑤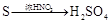 途径⑥
途径⑥
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole-和3mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时,正极:FePO4+Li++e- = LiFePO4,负极:Li-e- = Li+。下列说法中正确的是()
| A.充电时动力电池上标注“+”的电极应与外接电源的正极相连 |
| B.充电时电池反应为FePO4+Li++e- = LiFePO4 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上Li+得电子被还原 |
将1 mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g)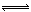 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
| A.等于0.3 mol | B.等于0.15 mol |
| C.小于0.15 mol | D.大于0.15 mol,小于0.3 mol |
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应:
①Br2 + 2e- = 2Br-②2Br- - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
| A.④和① | B.②和① | C.③和① | D.②和③ |
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的是
| A.c (CH3COO-)>c (Na+) |
| B.c (CH3COOH)+c (CH3COO-)="0.02mol/L" |
| C.c (CH3COOH)>c (CH3COO-) |
| D.c (OH-)>c (H+) |
钢铁在腐蚀过程中,下列变化可能发生的是
①铁元素由+2价转化为+3价 ②氧气被还原 ③产生氢气 ④Fe(OH)3失水生成Fe2O3·xH2O
⑤杂质碳被氧化而除去
| A.只有①② | B.只有③④ | C.只有①②③④ | D.①②③④⑤ |