化学与人类社会可持续发展密切相关,能源、环境、工业生产以及日常生活等都离不开化学。
(1)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式________________________;国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式_______________________。
(2)氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________。实验室可利用如右图所示装置完成该反应,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是____________________。
(3)三硅酸镁(Mg2Si2O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________。将0.184 g三硅酸镁加到50 mL 0.1 mo1·L-1盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用 0.1 mo1·L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O的n值为____________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示。请认真观察下图,然后回答问题: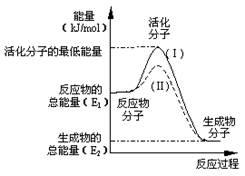
(1)图1中所示反应是____________(填“吸热”或“放热”)反应,该反应的△H=________(用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是_______________(填代号)。
a.盐酸与NaOH反应
b.Na与H2O反应生成H2
c.铝热反应
d.灼热的碳与CO2反应
辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是____,当1 mol O2发生反应时,还原剂所失电子的物质的量为_____mol, 其中被S 元素还原的O2的物质的的量为__________mol 。
有一包固体粉末,其中可以含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀盐酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原粉末中一定含有的物质是_______,可能含有的物质是。(以上各物质均写化学式)
(2)写出下列步骤中发生反应的离子方程式:①_______________;②_____________。
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2,其中硫元素化合价为-1价)氧化为Fe2(SO4)3,并使溶液酸性增强(生成硫酸)。
①该过程反应的化学方程式为________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
_____Cu2S+___Fe3++____H2O ___Cu2++Fe2++____()+SO42-
___Cu2++Fe2++____()+SO42-
完成离子反应,并改写成化学方程式
①_____+Ag+=___+Ag_________________。
②Fe2O3+_____=___Fe3++___________,__________________________。