常温下,下列各组离子在指定溶液中,一定能大量共存的是
| A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
| B.在0.1 mol·L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- |
| C.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32- |
| D.在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
下列说法正确的是
| A.碳碳间以单键结合的有机物一定是烷烃 | B.分子组成符合CnH2n+2的烃一定是烷烃 |
| C.正戊烷分子中所有原子均在一条直线上 | D.新戊烷的一氯取代物有2种 |
既能使溴水褪色又能跟金属钠反应,还可以和碳酸钠溶液反应的物质是 
某氯碱厂不慎有大量氯气逸出周围空间,此时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子。最适宜采用的物质是
A.NaOH B.NaCl C KBr D.Na2CO3
下列说法中正确的是
| A.石油裂解可以得到氯乙烯 |
| B.石油的裂化是为了得到乙烯和丙烯 |
| C.煤的干馏发生了化学变化 |
| D.煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯 |
已知 C2H2(g)+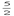 O2=2CO2(g)+H2O(l) △H=-1300kJ/mol 下列说法正确的是 (NA为阿伏加德罗常数值 )
O2=2CO2(g)+H2O(l) △H=-1300kJ/mol 下列说法正确的是 (NA为阿伏加德罗常数值 )
| A.有10NA个电子转移时,该反应吸收1300kJ的能量 |
| B.有NA个水分子生成且为气体时,放出1300kJ的能量 |
| C.有22.4升乙炔气体参与反应时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |