根据原子结构及元素周期律的知识,下列推断正确的是
| A.同周期金属元素,原子失电子能力越强,最高化合价越高 |
| B.同主族的单核阴离子,其还原性越强,氢化物的稳定性越弱 |
| C.第二周期元素从左到右,最高正价从+1递增到+7 |
| D.第三周期非金属元素对应的含氧酸酸性从左到右依次增强 |
常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。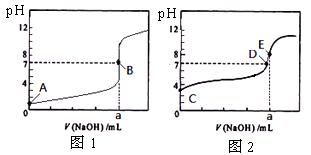
若以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)> c(H+) > c(OH—)
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中错误的是
| A.用溶解度数据判断煮沸Mg (HCO3)2溶液得到的产物是Mg(OH)2而不是 MgCO3 |
| B.用沸点数据推测将一些液体混合物用分馏的方法分离开来的可能性 |
| C.利用溶液的pH与7的大小关系,来判断任何温度下溶液的酸碱性 |
| D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱 |
据央视《每周质量报告》3·15节目《“健美猪”真相》报道,河南孟州等地养猪场采用违禁动物药品“瘦肉精”饲养.“瘦肉精”之一盐酸克伦特罗在全世界养猪业中的使用都是违法的,最近美国FDA批准的盐酸莱克多巴胺(另一种瘦 肉精)在猪中使用后,美国养猪户在使用前后有“黑夜与白天的差别”.莱克多巴胺其结构简式如下图.以下叙述中不正确的是
肉精)在猪中使用后,美国养猪户在使用前后有“黑夜与白天的差别”.莱克多巴胺其结构简式如下图.以下叙述中不正确的是
| A.C18H23NO3 |
| B.莱克多巴属于芳香族化合物 |
| C.每摩尔莱克多巴胺能与3molNaOH反应 |
| D.莱克多巴胺可燃, 燃烧时产可能产生有毒氮氧化物气体 |
下列说法正确的是
| A.聚乙烯可使酸性高锰酸钾溶液褪色 |
| B.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 |
| C.乙酸与乙醇的酯化反应中是乙酸中羧基氢与乙醇中羟基结合生成水 |
| D.C3H8的二氯代物有3种 |
2011年3月11日日本宫城发生9.0级大地震并引起海啸和核泄露,当地环境受到严重污染。下列有关说法正确的是
| A.海啸水退后可用漂白粉、84消毒液、ClO2的稀溶液进行消毒 |
| B.海啸使水源发生污染可用明矾进行消毒和净化 |
| C.核反应属于化学反应 |
| D.生物质能的缺点是严重污染环境 |