某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
| 检测序号 |
溶液中检测出的离子组合 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、AlCl3、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
则下列说法合理的是
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C.为了检验SO42-,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D.为了确定是否存在CO32-,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
已知高氯酸铵是火箭的一种燃料,加热时发生反应: NH4ClO4 →N2↑+ H2O↑+Cl2↑+ O2↑(方程式未配平),该反应放出大量的热。下列有关叙述不正确的是
| A.该反应属于分解反应,又属于氧化还原反应 |
| B.该反应是一个焓减和熵增的过程 |
| C.该反应中被还原的元素位于元素周期表中第三周期第VIIA族 |
| D.该反应的氧化产物只有氮气 |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 |
除杂试剂 |
分离方法 |
|
| A |
乙酸乙酯(乙酸) |
CCl4 |
萃取、分液 |
| B |
乙烷(乙烯) |
高锰酸钾溶液 |
洗气 |
| C |
乙醇(乙酸) |
新制氧化钙 |
蒸馏 |
| D |
苯(溴) |
碘化钾溶液 |
分液 |
在相同温度下,等体积、等物质的量浓度的4种稀溶液:①K2SO4②H2SO3③KHSO3④K2S。所含带电微粒数由多到少的顺序是
| A.①=④>③=② | B.④>①>③>② |
| C.①>④>③>② | D.④=①>③>② |
化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是
A.硫原子的原子结构示意图: |
B.过氧化氢电子式: |
| C.乙酸的的结构简式:C2H4O2 | D.原子核内有10个中子的氧原子: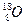 |
已知1~18号元素的离子aW3+、bX+、cY2−、dZ−都具有相同的电子层结构,下列关系正确的是
| A.离子的还原性Y2−> Z− | B.质子数c>b |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |