下列电离方程式错误的是
| A.KNO3 = K+ + NO3- |
| B.NaHSO4 = Na+ + H+ + SO42- |
| C.BaCl2 = Ba2+ + Cl2- |
| D.Na2SO4 = 2Na+ + SO42- |
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是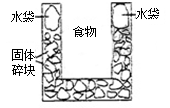
| A.硝酸铵 | B.生石灰 | C.氯化镁 | D.食盐 |
近年来,多地公共汽车大部分采用天然气或燃料电池作为动力,其主要目的是
| A.减少对大气的污染 | B.降低成本 |
| C.防止石油短缺 | D.加大发动机的动力 |
可逆反应:3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
| A.若C为固体,则B一定是气体 | B.B和C一定都是气体 |
| C.B和C可能都是固体 | D.B和C不可能都是气体 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
| C.300℃时,0-t1min内 CH3OH的平均生成速率为n1/2t1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平衡时n(H2)/n(CH3OH)减小 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |