有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
A.前20 min的平均反应速率v(C)=0.1 mol/(L·min)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L
A、B两元素原子分别得到两个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量,若A、B、C、D间相互形成化合物时,属于离子化合物的可能性最大的是( )
A.D2A B.C2B C.C2A D.D2B
下列各组元素性质的递变情况错误的是( )
| A.Na、Mg、Al原子最外层电子数依次增多 |
| B.P、S、Cl元素最高正价依次升高 |
| C.N、O、F电负性依次减小 |
| D.Na、K、Rb第一电离能逐渐减小 |
科学家最近制造出112号新元素的原子,其原子质量数为277,这是迄今已知元素中最重
的原子,关于该元素的下列叙述正确的是( )
| A.其原子核内中子数和质子数都是112 |
| B.其原子核内中子数为165,核外电子数为112 |
| C.其原子质量是12C原子质量的277倍 |
| D.其原子质量与12C的原子质量之比为277∶6 |
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂
化方式为( )
| A.直线形 sp杂化 | B.三角形 sp2杂化 |
| C.三角锥形 sp2杂化 | D.三角锥形 SP3杂化 |
下列化学式对应的结构式从成键情况看不合理的是( )
A.CH3N,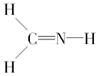 |
B.CH2SeO,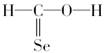 |
C.CH4S, |
D.CH4Si,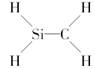 |