实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)下列操作中,容量瓶具备的功能有__ 。
| A.配制一定体积准确浓度的标准溶液 |
| B.贮存溶液 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.用来加热溶解固体溶质 |
(2)根据计算用托盘天平称取NaOH的质量为_____g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1 mol/L(填“大于”、“等于”或“小于”,下同(。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为____mL(计算结果保留一位小数。
原电池是一种________________________装置。电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:
Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
电池的负极是____________,正极发生的是____________反应(填反应类型),总反应式为___________________________________。
(1)在 H、
H、 H、
H、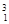 H、
H、 Mg、
Mg、 Mg和
Mg和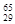 Cu中共有______种元素,______种原子。
Cu中共有______种元素,______种原子。
(2) 射线是由粒子组成的,粒子是一种没有核外电子的粒子,它带有2个单位正电荷,它的质量数等于4,由此推断粒子带有_________个中子。
有下列各组物质:
A.Al(OH)3与H3AlO3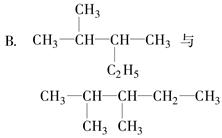
C.金刚石与石墨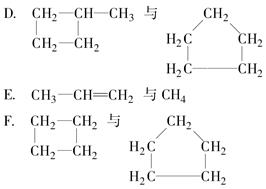
(1)互为同素异形体的是________。
(2)属于同系物的是________。
(3)互为同分异构体的是________。
(4)属于同一物质的是________。
人们对苯的认识有一个不断深化的过程。
(1)写苯与H2发生加成反应的化学方程式_________________________________________。
(2)烷烃中脱去2 mol氢原子形成1 mol双键要吸热,但1,3-环己二烯(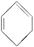 )脱去2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯__________(填“稳定”或“不稳定”)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯__________(填“稳定”或“不稳定”)。
(3)1866年凯库勒提出了苯是单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解决下列________事实(填入编号)。
| A.苯不能使溴水褪色 | B.苯能与H2发生加成反应 |
| C.溴苯没有同分异构体 | D.邻二溴苯只有一种 |
(4)现代化学认为苯分子碳碳之间的键是______。
写出下列变化的化学方程式,并注明反应条件和反应类型。
(1)乙烯和氯化氢__________________________________________;
(2)苯和浓硝酸__________________________________________;
(3)苯和溴_________________________________________。