根据右图回答,下列说法不正确的是
| A.此装置用于铁表面镀铜时,a为铁 |
| B.此装置用于电镀铜时,硫酸铜溶液的浓度不变 |
C.燃料电池中正极反应为 O2(g) + 2e- +2H+=H2O O2(g) + 2e- +2H+=H2O |
| D.若a为粗铜,b为纯铜,该装置可用于铜的精炼 |
H2和I2在一定条件下能发生反应:H2(g)+I2(g) 2Hl(g)△H="-a" kJ/mol。已知:
2Hl(g)△H="-a" kJ/mol。已知: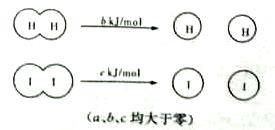
下列说法正确的是
| A.H2、I2和HI分子中的化学键都是非极性共价键 |
| B.断开2 mol Hl分子中的化学键所需能量约为(c+b+a))kJ |
| C.相同条件下,lmol H2(g)和lmol I2(g)总能量小于2 molHl(g)的总能量 |
| D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
某溶液中含有NH4+、SO32-、SiO32-、Br一、CO32-、.Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了3个氧化还原反应
| A.①⑦③④ | B.①③③④⑤ | C.①③④⑤ | D.②④⑤ |
下列图示的实验操作,不能实现相应实验目的的是
| A.鉴别甲苯与己烷 |
B.研究浓度对Fe3++3SCN- Fe(SCN)3的影响 Fe(SCN)3的影响 |
 |
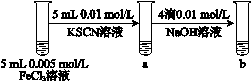 |
| C.检验CH3CH2OH与浓H2SO4加热至170℃的产物乙烯 |
D.比较碳酸钠与碳酸氢钠的热稳定性 |
 |
 |
下列推测或结论不合理的是
| A.X2-和Y+核外电子层结构相同,原子序数:X<Y |
| B.气态氢化物的稳定性HCl> HBr,还原性:Cl- >Br一 |
| C.硅、锗都位于金属与非金属的交界处,用途:都可以做半导体材料 |
| D.铷(37Rb)和锶(38Sr)分别位于第五周期lA和ll A族,碱性:RbOH>Sr(OH)2 |
已知A、B、C、D、E是短周期中原子序数依次增大的五种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的两倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.工业上常用电解法制备元素C、D、E的单质
B.元素A、B组成的化合物常温下一定呈气态
C.化合物AE与CE含有相同类型的化学键÷
D.元素C、D的最高价氧化物对应的水化物之间肯定不能发生反应