某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如下图所示。下列判断正确的是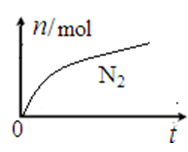
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
下列关于Na2O2的叙述,正确的是 ( )
| A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1:1 |
| B.Na2O2晶体为离子晶体,且含极性共价键 |
| C.Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 |
| D.Na2O2与盐酸反应,不仅有盐和水生成,同时会放出无色气体 |
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ()
A.溶质的质量分数为 |
| B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
C.溶液中 |
D.溶质的物质的量浓度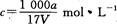 |
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
| A.该反应中的氧化剂是C12 |
| B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12 |
| D.根据该反应可判断还原性:S2O32->C1— |
下列各选项中的两个反应,可用同一个离子方程式表示的是 ( )
| 选项 |
Ⅰ |
Ⅱ |
| A |
Ba(OH)2溶液与过量NaHCO3溶液混合 |
NaOH溶液与过量NaHCO3溶液混合 |
| B |
少量SO2通入Ba(OH)2溶液中 |
过量SO2通入Ba(OH)2溶液中 |
| C |
BaCl2溶液与Na2SO3溶液混合 |
Ba(OH)2溶液与H2SO3溶液混合 |
| D |
少量氨水滴入AlCl3溶液中 |
少量AlCl3溶液滴入氨水中 |
下列说法中正确的是 ( )
| A.一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定为1 mol/L |
| B.标准状况下,22.4L的己烷中有20×6.02 × 1023个原子 |
| C.1 mol氯气溶于水转移6.02× 1023个e— |
| D.0.1 mol CH5+含6.02 × lO23个e一 |