有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现向这两种盐的溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO32NaR1+CO2+H2O=2HR1+Na2CO3。HR和HR1的酸性强弱比较,正确的是( )
| A.HR较B弱 | B.HR1较弱 | C.两者相同 | D.无法比较 |
将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。则原合金样品中镁的质量为
| A.4.8 g | B.6 g | C.9.6 g | D.12 g |
1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是
| A.适当升温,两溶液的pH均增大 |
| B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同 |
C.0.1 mol/L Na2CO3溶液中 |
D.0.1 mol/L NH4Cl溶液中 |
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)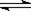 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
| A.SO2的转化率为30% |
| B.反应共放出了196.6 kJ的热量 |
| C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1 |
| D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同 |
下列离子检验的结论可靠的是
| A.用干燥洁净的铂丝蘸取溶液,在火焰上灼烧,若火焰呈黄色,证明不含K+ |
| B.向溶液中加入新制氯水和CCl4,振荡、静置,若上层溶液呈紫红色,证明含有I— |
| C.向溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+ |
| D.向溶液中加入氢氧化钠溶液,若立即产生红褐色沉淀,证明含有Fe3+ |
X、Y、Z、W四种短周期元素在周期表中相对位置如表所示,Y、Z质子数之和为21,下列说法中不正确的是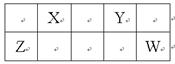
| A.X、Y、Z、W均为非金属元素 |
| B.Y、Z形成的化合物为离子晶体 |
| C.乙的阳离子与Y的阴离子电子层结构相同 |
| D.X、Y、W的氢化物中,Y的氢化物沸点最高 |