某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量的海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有(填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架 E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是_____________________________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用__________(填代号)。理由是
_______________________________________________________________________。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显
___________,则证明海带中含碘。
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取W g该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。现按图1-3装置进行实验:
完成下列问题: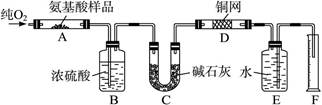
图1-3
(1)实验开始时,首先要通入一段时间的氧气,其理由是______________________________。
(2)以上装置中需要加热的仪器有___________________________,操作时应先点燃_______处的酒精灯。(填写字母)
(3)A装置中发生反应的化学方程式是_____________________________________________。
(4)装置D的作用是_____________________________________________________________。
(5)读取氮气体积时,应注意______________________________________________________。
(6)实验中测得氮气的体积为V mL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有______________________。
| A.生成二氧化碳的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的相对分子质量 |
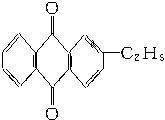
工业上可用乙基蒽醌制备H2O2,其工艺流程简单表示如下: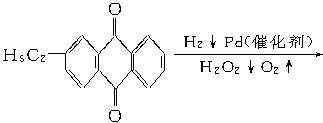
回答:
(1)上述反应中涉及氧化反应的方程式为__________________________________________。涉及还原反应的方程式为________________________________________________________。
(2)“绿色化学”是当今社会提出的一个新概念。在绿色化学中,一个重要的衡量指标是原子的利用率,其计算公式为:
原子利用率=期望产物的总质量与生成物的总质量之比
如:CH2====CH2+Cl2+Ca(OH)2
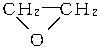 +CaCl2+H2O,则制备
+CaCl2+H2O,则制备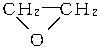 工艺的原子利用率为
工艺的原子利用率为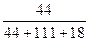 ×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
某工厂为除去所排放废气中的Cl2对环境的污染,设计如下除氯方案:将含Cl2的废气通过盛有铁粉的FeCl3溶液即可有效除去Cl2,整个过程只要定期补充铁粉即可。写出除氯过程中有关反应的化学方程式,并指出本方案的优点。
(6分)如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是______________________。试管里的水面会上升,最终上升高约为___________,原因是____________________________________________。