I.X、Y是相邻周期、相邻主族的短周期元素,且原子序数X>Y.填写下列空白:
(1)若X为金属元素,Y为非金属元素,Y2H4是一种重要有机化工原料。
①X单质与Fe2O3反应时,每消耗13.5g X放热213kJ,该反应的热化学方程式是 ;
②写出实验室制备Y2H4的化学方程式 ;
(2)若X、Y元素的最高价氧化物的水化物都是强酸。
为防止YO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
YO2+G Y2+H2O+n Z(未配平,n可以为0)
Y2+H2O+n Z(未配平,n可以为0)
①上述反应式中的G不可能是 (填标号)。
A.NH3 B.CO C.CH3CH2OH
②25℃时,往a mol•L﹣1的YH3的水溶液(甲)中滴加0.01mol•L﹣1H2XO4溶液(乙),当甲与乙等体积混合时,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (用含a的代数式表示)。
Ⅱ.离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7﹣和AlCl4﹣组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
Ⅲ.甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g) △H="b" kJ/mol,为研究平衡时CO的转化率与反应物投料比( )及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:
)及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:

(1)反应热b 0 (填“>”或“<”)。
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,A点的平衡常数KA= ,B点的平衡常数KB KA(填“>”或“<”或“=”)。
(3)为提高CO转化率可采取的措施是 、 (答出两条即可)。
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。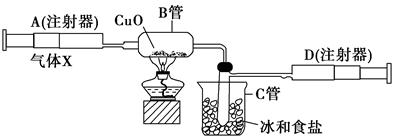
在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。
Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的物质的量浓度。
(1)在容量瓶的使用方法中,下列操作不正确的是(填字母)________。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液润洗 |
| C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
| D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(2)现需配制250 mL 0.100 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要________________。
(3)需准确称取Na2S2O3固体的质量为________g。
(4)另取废水50.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O62-。则该工厂废水中Ba2+的物质的量浓度为________。
2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的反应,该反应属于(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为,D的化学式是。
②A、B、E中均含有的一种元素符号为。
③C与纯碱反应的化学方程式为。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为。
半透膜与滤纸一样有许多小孔,但孔径比滤纸小,只能通过较小的离子和分子,胶体分散质不能通过半透膜。现把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入用半透膜制成的袋内,将此袋浸入烧杯内的蒸馏水中。2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验。
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是。
(2)用另一支试管里的溶液设计实验,证明胶体粒子是否存在?。
(3)由上述实验得出的结论是。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g)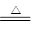 TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
有关物质性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其他 |
| CCl4 |
-23 |
76 |
与TiCl4互溶 |
| TiCl4 |
-25 |
136 |
遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l)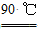 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下: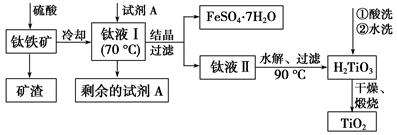
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是__________________________________________
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。