氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,浓度均为0.1mol/L的亚硝酸(HNO2)、次氯酸两种溶液,它们的电离常数Ka分别为:7.1×10﹣4、2.98×10﹣8。将0.1mol/L的亚硝酸稀释,c(H+)将 (填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”) 。写出涉及HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的化学方程式 。
(2)羟胺(NH2OH)可看成是氨分子内的l个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因 。
(3)磷及部分重要化合物的相互转化如图1所示。
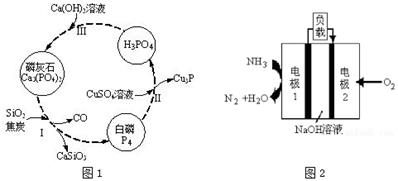
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 mol。
(4)若处理后的废水中c(PO43﹣)=4×10﹣7 mol•L﹣1,溶液中c(Ca2+)= mol•L﹣1。(已知Ksp[Ca3(PO4)2]=2×10﹣29)
(5)某液氨﹣液氧燃料电池示意图如图2,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol•L﹣1,则该过程中需要氨气的质量为 g。(假设溶液电解前后体积不变)
(8分)在反应: Fe2O3 +2 Al = Al2O3 + 2Fe 中,______元素的化合价升高,该元素的原子______电子,被________;______元素的化合价降低,该元素的原子______电子,被_________;该反应中,___________是氧化剂,___________是氧化产物。
(14分)(1)448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为,R的相对原子质量为
(3)5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
根据图示填空。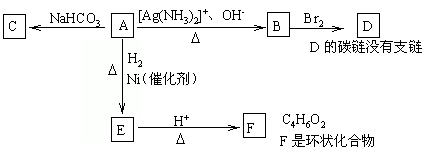
(1)化合物A含有的官能团是_________________。
(2)1molA与2molH2反应生成1molE,其反应方程式是__________________。
(3)与A具有相同官能团的A的同分异构体的结构简式是___________________。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是_____________________。
(5)F的结构简式是__________。
有机物A的分子式为C3H6O2,它与NaOH溶液共热,得到含B的蒸馏物。将B与浓硫酸混合加热,控制温度可以得到一种能使溴水褪色,并可做果实催熟剂的无色气体C。B在有铜存在时加热,可被空气氧化成D,D与新制的Cu(OH)2悬浊液加热煮沸,有红色沉淀和E生成。
(1)写出下列物质的结构简式:
A BC
DE
(2)B与浓硫酸混合加热得到气体C的化学方程式,该反应的反应类型为。
(3)B在有铜存在时加热,被空气氧化成D反应方程式
医药阿斯匹林的结构简式如图1所示: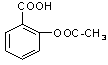
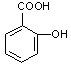
图1图2
试根据阿斯匹林的结构回答;
(1)(3分)阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团是。
(2)阿斯匹林跟小苏打同时服用,可使上述水解产物A与小苏打反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是。
(3)上述水解产物A与氢氧化钠溶液反应的化学方程式为
;
(4)上述水解产物B与乙醇、浓硫酸共热反应的化学方程式为
。