下列反应的方程式正确的是( )
| A.2mol/L NaAlO2溶液与5 mol/L盐酸等体积混合:2AlO2-+ 5H+=Al(OH) 3↓+ Al3+ + H2O |
| B.表示H2SO4与NaOH反应的中和热:H2SO4 + 2NaOH = Na2SO4 + 2H2O △H= —57.3kJ/mol |
| C.向Na2SiO3溶液中通入过量SO2:SiO32-+ SO2 + H2O = H2SiO3↓+ SO32- |
| D.2KMnO4 + HCOOK + KOH = 2K2MnO4 + CO2↑ + H2O |
下列有关实验的叙述正确的是()
| A.测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯 |
| B.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下口放出 |
| C.NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量液体即停止加热 |
| D.在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3 |
下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是()
| A.①>②>③>④>⑤ | B.⑤>①>③>②>④ |
| C.⑤>①>②>③>④ | D.⑤>②>①>③>④ |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阳极上发生反应的是()
Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阳极上发生反应的是()
| A.Ni(OH)2 | B.Cd(OH)2 | C.Cd | D.NiOOH |
下列叙述正确的是()
A.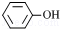 和 和 互为同系物 互为同系物 |
| B.配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 |
| C.活化分子之间的碰撞不一定都是有效碰撞反应 |
| D.对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加 |
下列有机物实际存在且命名正确的是()
| A.2-甲基-5-乙基己烷 | B.3,3-二甲基-2-戊烯 |
| C.3-甲基-2-丁烯 | D.2,2-二甲基丙烷 |