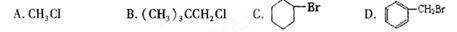短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a–b),L层电子数为(a+b)。则甲、乙两元素形成的化合物具有的性质是( )
| A.与水反应 | B.与氢氧化钠溶液反应 |
| C.与硫酸反应 | D.与前三种物质均能反应 |
一种气态烷烃和一种气态烯烃组成的混合气体共10g,其密度是相同条件下H2的12.5倍,该混合气通过Br2水时,Br2水增重8.4g,则组成该混合气的可能是
| A.甲烷、乙烯 | B.丙烷、乙烯 | C.乙烷、丙烯 | D.甲烷、丙烯 |
新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
下列说法正确的是
| A.上述反应为取代反应 |
| B.维生素C在酸性条件下水解只得到1种产物 |
| C.维生素C不可溶于水,可溶于有机溶剂 |
| D.脱氢维生素C的分子式为C6H8O6 |
2-甲基丁烷跟氯气发生取代反应,可能得到一氯代物,该一氯代物水解后可得到()种醇。
| A.1 | B.2 | C.3 | D.4 |
下列关于苯酚的叙述中,错误的是
| A.碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 |
| B.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 |
| C.其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 |
| D.其水溶液显强酸性,俗称石炭酸 |
能在KOH的醇溶液中发生消去反应的是