CuO、Fe粉、Fe3O4的混合物中,加一定量稀硫酸,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后.取出铁钉,观察现象。以下结论中正确的是( )
| A.若铁钉部分溶解,则滤液中一定含Fe2(SO4)3 |
| B.若铁钉完全溶解,则滤液中一定含CuSO4 |
| C.若铁钉表面有红色物质生成,则不溶物中一定不含Fe |
| D.若铁钉无变化,则不溶物中一定含Fe |
某密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H <0下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是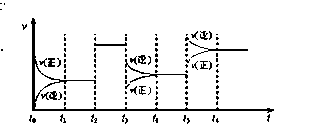
| A.t3时减小了压强 |
| B.t5时增大了压强 |
| C.t6时刻后反应物的转化率最高 |
| D.t1 - t2时该反应的平衡常数大于t6 时反应的平衡常数 |
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2++2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
对于可逆反应2HI(g)  I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
| A.各物质的量的浓度比2 : 1: 1 |
| B.容器内的总压不随时间变化 |
| C.生成2 mol H-I键的同时生成1 mol I-I键 |
| D.混合气体的颜色不再变化时 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是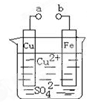
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
水的电离过程为H2O H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
KW(35℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随温度的升高而降低 | B.35℃时,c(H+)>c(OH-) |
| C.氯化钠溶液中KW (35℃) <KW (25℃) | D.水的电离是吸热的过程 |