有A、B、C、D、E、F六种短周期元素,其原子序数依次增大,A的单质分子内不含中子,B的某种同素异形体可以用于制作铅笔芯,C是形成氧化物种类最多的元素, D2—与E2+具有相同的电子层结构,F原子的最外层电子数与其电子层数相等。
(1)A单质的结构式 ;E2+的离子结构示意图 。
(2)C、D、E、F四种元素简单离子的离子半径由大到小的排列顺序为(用离子符号表示) 。
(3)由A和C两种元素可形成多种分子,其中有一种A、C原子个数比为3:1的分子,其电子式为 ;另一种分子中其原子个数比为2:1,已知在101kPa时,32.0g该液态化合物在氧气中燃烧,其中一种生成物为C元素形成的单质,放出热量624kJ (25℃时),写出该热化学方程式 。
(4)某抗酸药物只含A、B、D、E、F五种元素,取一定量该抗酸药进行如下实验:
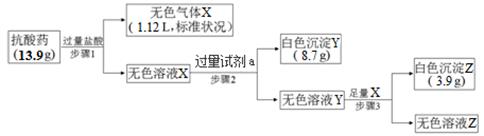
过量试剂a是 ;通过计算可知该抗酸药的化学式为 。
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,
其余为氧。A的相关反应如下图所示:
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。根据以上信息回答下列问题:
(1)A的分子式为 ;
(2)反应②的化学方程式是 :
(3)A的结构简式是 ;
(4)反应①的化学方程式是 。
(5)A有多种同分异构体,写出四个同时满足:
(i)能发生水解反应;
(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:
、 、
、 ;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
按要求完成下列各题:
(1)写出乙醛与氢气反应的化学方程式:
。
(2)正丙醇催化氧化反应的化学方程式:
。
(3)丙醛和新制备的银氨溶液的反应:
 。
。
(7分)已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平的标志。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。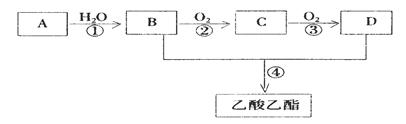
回答下列问题:
(1)B、D分子中官能团名称分别是 、 。
(2)写出下列反应的反应类型:① 反应,
②  反应,④ 反应。
反应,④ 反应。
(3)写出下列反应的化学方程式:
③ ;④
;④
下图是元素周期表的一部分,表 中的①~⑩中元素,用元素符号或化学式填空回答:
中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)用电子式表示②与④形成化合物的 过程 。
过程 。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是 。
(4)写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:
。
(14分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: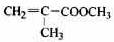
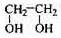


(甲) (乙) (丙 ) (丁)
) (丁)
填写下列空白:
(1)甲中不含氧原子的官能团是___________________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液b.石蕊溶液c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):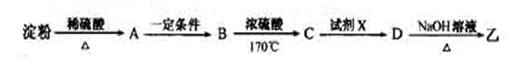
B的分子式是___________,试剂X可以是___________。
(4)已知: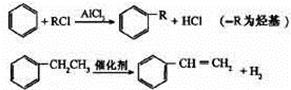
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为。